このページでは、東京都に事務所等を設置して、医療機器・体外診断用医薬品を国内で製造する場合、または海外から輸入する場合に必要な許可・登録に関する東京都での手続きについて説明します。
他道府県にて事務所等を設置して業務を行う場合は、所管の自治体にお問い合わせください。
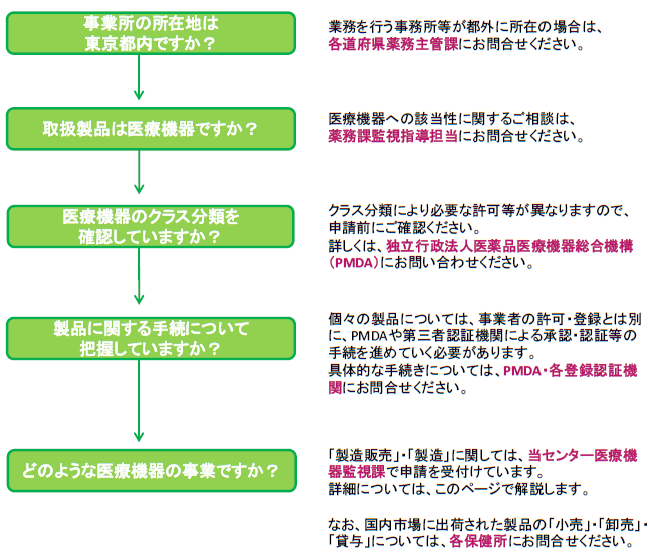
医療機器の申請を行う前に
医療機器を取り扱うためには、業許可、製品に関する承認・認証等、様々な手続きが必要です。手続きの内容により、申請先が異なりますのでご注意ください。
当センター医療機器監視課では、製造販売業許可及び製造業登録に関する申請を受付けています。
医療機器に関する申請を行う前に、あらかじめ下記フロー図をご確認ください。
医療機器に該当するかを確認したい場合は、薬務課監視指導担当(03-5320-4512:予約制)にお問い合わせください。
クラス分類及び一般的名称の検索は、独立行政法人医薬品医療機器総合機構 医療機器基準関連情報を御利用ください。
個々の医療機器・体外診断用医薬品の申請・届出に関しては、独立行政法人医薬品医療機器総合機構または各登録認証機関へお問い合わせください。
販売業・貸与業(小売・卸売・貸与等)については、営業所の所在する各保健所までお問い合わせください。
医療機器とは(医薬品医療機器等法第2条第4項)
人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等(再生医療等製品を除く。)であって、政令で定めるものをいいます。
政令で定めるものとは医薬品医療機器等法施行令第1条の別表第1に記載されています。
体外診断用医薬品とは(医薬品医療機器等法第2条第14項)
専ら疾病の診断に使用されることが目的とされている医薬品のうち、人又は動物の体に直接使用されることのないものをいいます。
医療機器・医薬品等に該当するか確認したい場合は、薬務課監視指導担当にお問い合わせください。
医療機器・体外診断用医薬品の製造販売、製造について
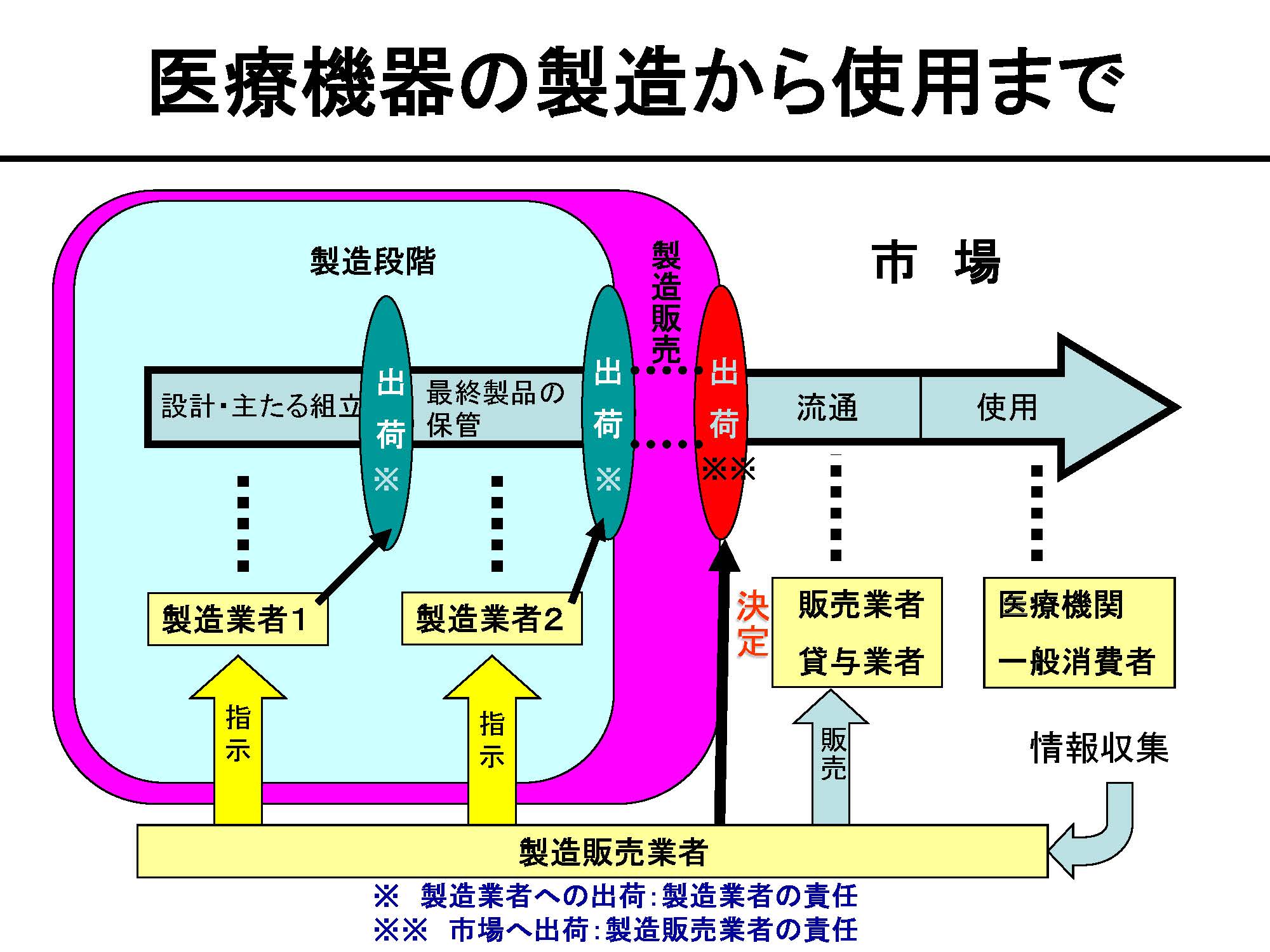
医療機器・体外診断用医薬品を製造若しくは海外から輸入することにより、国内の市場に流通させるには、品目に応じた製造販売業の許可が必要です。
医療機器・体外診断用医薬品の製造を行うには、製造業の登録が必要です。
製造販売業と製造業は、行うことのできる行為が全く異なります。
なお、製造販売業者により国内の市場に出荷された製品を流通させるには、販売業の許可等が必要になります。詳細は、販売業を所管している窓口(医療機器・体外診断用医薬品)にお問い合わせください。
医療機器の製造から使用まで
製造販売とは(医薬品医療機器等法第2条第13項)
製造等(他に委託して製造をする場合を含み、他から委託を受けて製造をする場合を除く。)をし、又は輸入をした医薬品若しくは医療機器を、それぞれ販売し、貸与し、若しくは授与し、又は医療機器プログラム(医療機器のうちプログラムであるものをいう。)を電気通信回線を通じて提供することです。
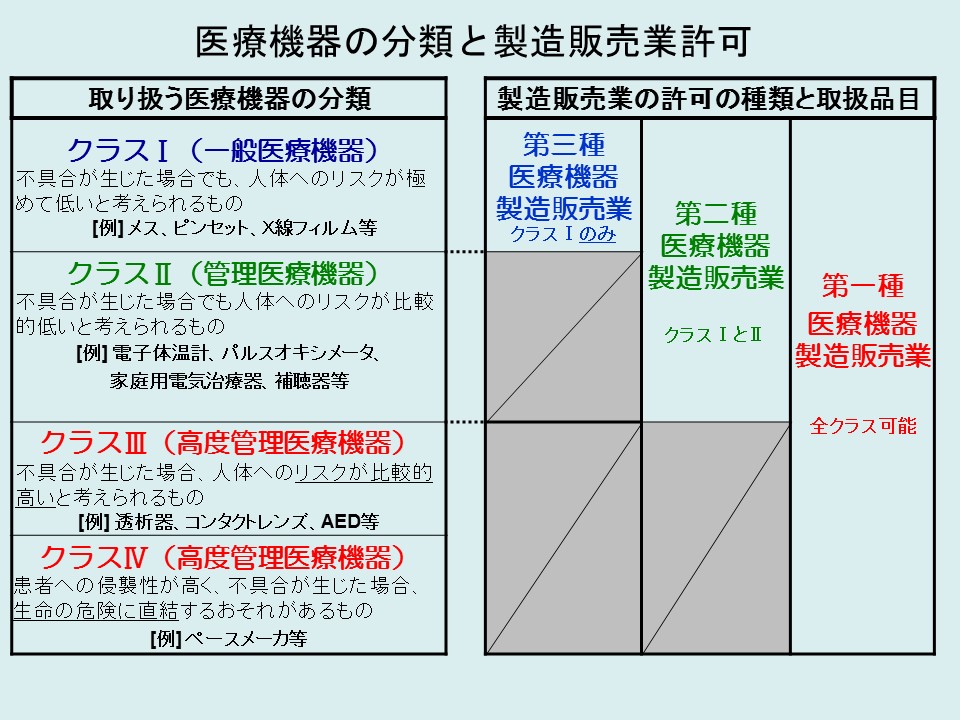
取り扱う品目に応じて、必要とされる許可の種類が異なります。医療機器を取り扱う場合は、自社で取り扱う製品が該当するクラス分類を確認した上で、必要な種類の許可を申請してください。
医療機器のクラスに対応した許可を取得
クラス分類及び一般的名称の検索は、独立行政法人医薬品医療機器総合機構 医療機器基準関連情報を御利用ください。
医療機器等製造販売業許可申請書については、こちらのページをご覧ください。
製造とは
医療機器・体外診断用医薬品を製造することです。
製造工程のうち設計、組立て、滅菌その他厚生労働省で定めるものを行う製造所については、品目に応じた製造業登録をする必要があります。厚生労働省で定める製造工程は、製造する品目の種類に応じ、次の通り規定されています。
製造販売業において登録すべき製造所を検討する際に疑義がある場合は、対象となる品目の定期QMS調査申請を行う調査実施者に照会してください。
| 製造品目の種類 | 製造工程 |
| 医療機器プログラム | 設計 |
|
医療機器プログラムを記録した 記録媒体たる医療機器 |
設計 |
| 国内における最終製品の保管 | |
| 一般医療機器(クラスⅠ) |
主たる組立てその他の主たる製造工程 (設計、滅菌及び保管を除く) |
| 滅菌 | |
| 国内における最終製品の保管 | |
|
上述の医療機器以外の医療機器 (クラスⅡ以上) |
設計 |
|
主たる組立てその他の主たる製造工程 (設計、滅菌及び保管を除く) |
|
| 滅菌 | |
| 国内における最終製品の保管 | |
| 放射性体外診断用医薬品 | 設計 |
| 反応系に関与する成分の最終製品への充填工程以降の全ての製造工程 | |
|
放射性・届出対象体外診断用医薬品以外の体外診断用医薬品 |
設計 |
| 反応系に関与する成分の最終製品への充填工程 | |
| 国内における最終製品の保管 | |
| 届出対象体外診断用医薬品 | 反応系に関与する成分の最終製品への充填工程 |
| 国内における最終製品の保管 |
医療機器等製造業登録申請書については、こちらのページをご覧ください。
その他の必要となる手続き
外国の製造所で医療機器・体外診断用医薬品を製造している場合
・「外国製造業者登録」の登録申請
品目について(取り扱い品目に応じて、次の手続きが必要)
(1)製造販売承認申請
承認申請の進行状況に応じて、承認書に記載した製造所(海外製造所、国内製造所)に ついて「適合性調査」の申請を行い、製造所の製造管理または品質管理の方法が基準(QMS省令)に適合しているか調査を受ける必要があります。
(2)製造販売認証申請
認証申請の進行状況に応じて、認証書に記載した製造所(海外製造所、国内製造所)に ついて「適合性調査」の申請を行い、製造所の製造管理または品質管理の方法が基準(QMS省令)に適合しているか調査を受ける必要があります。
(3)製造販売届
申請窓口一覧
| 担当部署名 | ||
| 業 | 製造販売業 |
東京都健康安全研究センター 広域監視部 医療機器監視課 医療機器審査担当 電話 03-5937-1044 |
| 製造業 | ||
| 修理業 | ||
| 品目 | 承認 |
独立行政法人 医薬品医療機器総合機構 審査業務部 業務第二課 電話 03-3506-9509 |
| 製造販売届 | ||
| 適合性調査 ※ | ||
| 認証 | 登録認証機関(法第23条の2) | |
| 適合性調査 ※ | ||
| 輸入 | 外国製造業登録 |
独立行政法人 医薬品医療機器総合機構 審査業務部 業務第二課 電話 03-3506-9509 |
登録認証機関については以下のリンクを参照してください。